难治耐药结核患者(MDR和XDR)新致病机制浅谈
2022-10-18 09:42 来源:东方网 作者:刘忠华
难治耐药结核患者的影响
近二十年中,结核菌耐多药(MDR)、广泛耐药(XDR)患者不断增加成为全世界公认的公共卫生威胁。据估计,在未来35年,耐药结核病将导致约7500万人死亡,造成全球经济损失16.7万亿美元,制定新的耐药结核病预防和治疗战略尤为关键[1]。事实上,全球由于新冠大流行造成资源缺乏和结核病流行地区的强制禁闭,可能造成630万例新的结核病病例[2]。近年来,我国伴随经济的高速发展,人口的快速流动,生活压力的变化,过劳现象普遍存在,基于过劳导致的免疫力下降,治疗依从性差形成的继发性耐药和直接感染耐药株的获得性耐药患者人群不断扩大。现阶段我国结核病流行态势呈现出高潜伏、高耐药、耐多药(MDR)和广泛耐药(XDR),基于以上原因的难治疗和高复发率现象[3]。
难治耐药菌的形成
结核患者持续暴露于药物和不遵守药物方案下,由单药耐药迅速演变为 MDR(XDR)。耐药的进化动力是结核菌外部因素和内在因素相互作用的结果:外部因素,人的社会因素与结核控制和预防服务质量相关;内在因素,与耐药基因突变相关。研究表明,获得性耐药是突变逐步获得和固定化从而诱导耐药性逐渐增加,由异烟肼耐药性获得开始,其次是利福平或乙胺丁醇耐药性等等。现实世界,绝大多数研究者和资金集中于MDR(XDR)细菌本身,不断有新药出现,可短暂使用后又产生耐药。这种无解循环造就了MDR(XDR)患者在中国和世界都有不断增加的趋势。
结核分枝杆菌除了异质化,也是一种高度专一的人类细胞内病原体,基因组极其保守,导致了一种近乎完美的宿主-病原体关系[4]。系统发育树推断表明,目前全球有7个结核杆菌谱系。在同域和异域寄主-病原体组合下与人类种群共同进化。结核分枝杆菌谱系在地理分布、生物适应性、毒力和耐药倾向方面存在差异;具体而言,7个谱系中2、4谱系与疾病负担和耐药性相关(如下图)。这些耐药结核菌通过较高的疏水性长时间以雾化方式传播,吸入宿主肺微环境,可在细胞外,逃离坏死细胞,或在空腔中重新激活;或细胞内,如肺泡巨噬细胞(AMs),或潜伏在肉芽肿中。耐药菌进化为利用宿主资源来发挥自身优势并调整其新陈代谢,以逃避宿主免疫系统、生存并建立成功的主动或潜伏感染。因此,大多数耐药菌对宿主反应保有相似或大概率的一致性,为针对耐药菌本身的特有免疫机制研究提供了科学基础,即MDR(XDR)宿主反应的特异的同质性。
难治耐药结核患者新致病机制
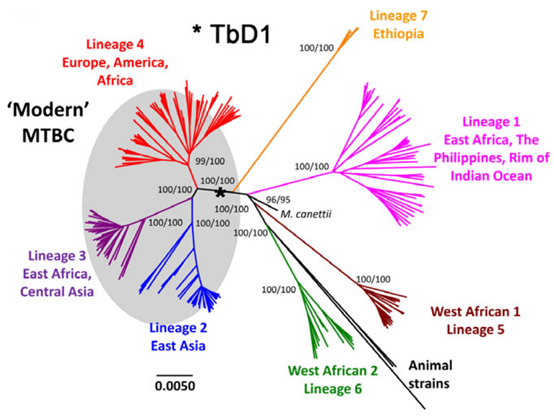
图片来源:Daniela Brites, Sebastien Gagneux,doi: 10.1111/imr.12264.
MDR和XDR菌的异质性和同质性决定患者治疗更加困难,因此,耐药患者治疗非常昂贵且用药时间超长。耐药菌长时间感染人体,赋予其进入肺微环境长期与宿主细胞外分子,细胞膜表面分子和细胞内分子的相互作用,不断改变自己并利用宿主资源来进化自身优势。因此,MDR和XDR耐药菌形成特有的适应宿主的免疫机制需要更有力的临床研究,以回答宿主免疫反应的改变是耐药结核病发展的影响还是原因,更为关键的是人类作为环境压力决定因素在耐药结核病发展中的具体机制仍是一个相对未探索的研究领域。
我们分析800多位结核患者资料,分析敏感株和耐药株患者(83%MDR和6%XDR)的免疫细胞,发现耐药菌患者在带菌,免疫系统正常的情况下,人的免疫系统形成截然不同的免疫反馈现象。主要表现为敏感菌患者总淋巴细胞下降,参与炎症反应的中性粒细胞,炎性因子(IL6,TNF-a等)等显著升高;而耐药菌患者总淋巴细胞未明显下降,且中性粒细胞和炎性因子等接近健康患者。提示耐药患者在长期的带菌过程中,耐药菌使免疫系统形成了免疫无能现象,这种免疫无能使患者体内携带更多结核菌,更难治愈和更高的死亡率。相似的结果我们在小鼠体内也得到了验证。对于这新的免疫机制的了解,为耐药菌MDR (XDR)干预和治疗提供了新的思路,也对结核病免疫提出了全新的认识。
参考文献
1.Anna Allué-Guardia , Juan I García , Jordi B Torrelles. Evolution of Drug-Resistant Mycobacterium tuberculosis Strains and Their Adaptation to the Human Lung Environment. Front Microbiol. 2021 Feb 4;12:612675.
2.WHO (2019). Global Tuberculosis Report 2019. Geneva: WHO.
3.WHO(2008) Global tuberculosis control-surveillance,planning,financing. In world Health Organization Report. Htt://www.who.int/tb/publications/global_report/2008/en/index.html.
4.Daniela Brites , Sebastien Gagneux. Co-evolution of Mycobacterium tuberculosis and Homo sapiens. Immunol Rev. 2015 Mar;264(1):6-24.
(作者系上海市肺科医院结核病实验室 刘忠华)
